Le Projet d'APTA
1. Effet de l’activité physique et compréhension de ses mécanismes biologiques sur les risques thromboemboliques et d’instabilité de la plaque d’athérome carotidienne
1.1. Approche épidémiologique
L’activité physique et la sédentarité seront évaluées par questionnaire, par notre équipe, dans des études épidémiologique prospectives de risques d’évènements ischémiques pilotées au niveau local par le service de Chirurgie Vasculaire et Endovasculaire des HCL (ESCT2 et ACABII). Cette approche épidémiologique permettra de connaitre l’effet prospectif des niveaux d’activité physique et de sédentarité à l’inclusion des patients sur le risque d’évènements ischémique et thromboembolique. PI : A Millon.
1.2. Approche clinique
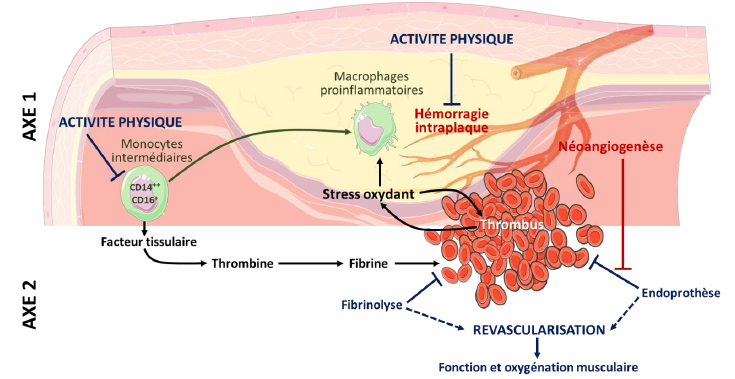
Comme décrit dans l’introduction, nous avons montré au travers d’une étude transversale que la prévalence de l’hémorragie intraplaque carotidienne, facteur majeur d’instabilité de la plaque, l’hyper-agrégation érythrocytaire et le pourcentage de monocytes intermédiaires, étaient diminués chez les patients les plus physiquement actifs (Mury et al. 2019 ; Mura et al. 2019 ; Mury et al. 2017). En outre, les caractéristiques structurales du thrombus et les conséquences sur le risque ischémique pourraient être modulées par l’activité physique (Kumar et al. 2011). Dans ce premier projet, l’impact d’une intervention en activité physique en condition écologique sera déterminé sur les facteurs de risque d’instabilité de la plaque carotidienne (hémorragie intraplaque, néovascularisation, chappe fibreuse) par IRM, le phénotype des monocytes circulants, la structure du thrombus et la cinétique de formation/contraction/lyse, la rhéologie des globules rouges, le stress oxydant, la condition physique et la qualité de vie chez des patients dont le bénéfice/risque de l'endartériectomie est défavorable. Ce type d’intervention en activité physique en condition écologique a déjà été validé par notre équipe sur une cohorte de patientes avec cancer du sein métastatique en utilisant des bracelets d’activité connectés et en réévaluant un nombre de pas quotidien bimensuellement (Delrieu et al. 2019). PI : V Pialoux & A Millon.
1.3. Approches fondamentales
Pour comprendre les mécanismes conduisant l’activité physique et la sédentarité à moduler le phénotype (voir review de Aw et al. 2018 in Antioxidants) et la fonction des monocytes (relargage de cytokines et chimiokines pro et anti-inflammatoires, propriété phagocytaire), des techniques de protéomique, multiplex sur plaque et plasma de patients actifs ou sédentaires et de culture de monocytes in vitro seront utilisées. PI : V Pialoux & A Millon.
Il a été suggéré que le phénotype des monocytes circulants pouvait moduler le risque de thrombose veineuse (Thaler et al. 2018). Pour répondre à cette question chez des patients à risques d’AVC ischémiques (sténose carotidienne > 50%), des approches in vitro recombinants des monocytes activés (artificiellement ou issus de patients) ou non (sujets sains) dans du sang de patients ou de sujets sains et des expérimentations in vitro de caractérisation structurale et de cinétique de formation/contraction/lyse des caillots sanguin seront utilisées. PI : C Romanet-Faes & V Pialoux.
En s’appuyant sur nos résultats montrant que l’activité physique diminue le ratio de monocyte intermédiaire (Mura et al. 2019) et que ce type de monocyte exprimerait plus de facteur tissulaire (Thaler et al. 2018), les mécanismes moléculaires et cellulaires reliant l’activité physique, les facteurs d’expression monocytaires (en particulier l’implication du facteur tissulaire) et la cinétique de formation/contraction/lyse des caillots sanguin seront étudiés. PI : V Pialoux.
2. Optimisation de traitements chirurgicaux et pharmacologiques de revascularisation
2.1. Approches cliniques
Un des paramètres majeurs qui affecte la fibrinolyse est la composition du thrombus ; et la composition est elle-même influencée par l’âge du thrombus (Silvain et al. 2011) ainsi que par son origine (artérielle, veineuse, coronarienne, cérébrale) (Sadowski et al. 2014; Sato et al. 2012; Silvain et al. 2011). Au regard de ces différences, la réponse aux traitements fibrinolytiques est différente et affecte par conséquent la durée d’ischémie. La complexité à laquelle se heurte les chirurgiens est la caractérisation de la structure du caillot afin d’optimiser le type et la durée du traitement. Les effets de la structure, de la composition, des propriétés physique et mécanique des thrombi artériels (par des approches in et ex vivo) au niveau des membres inférieurs sur la durée de fibrinolyse via un traitement à l’urokinase seront analysés. L’impact de la durée de la revascularisation (doppler) sur l’oxygénation (NIRS) et la fonction musculaire des membres inférieurs sera mesurés. Aussi, pour parvenir à cette caractérisation, une des spécificités de ce projet est l’association de biologistes, physiologistes, radiologues et physiciens. PI : C Romanet-Faes & A Millon.
Il a été proposé que le signal hypoxique et la néovascularisation pourraient être à l’origine d’une partie des échecs non-mécaniques de la chirurgie d’anévrisme abdominale par endoprothèse, l’endofuite de type 2 (Faes et al. soumis). D’autre part, les environnements redox et pro-inflammatoire du caillot de l’anévrisme pourraient être impliqués dans l’activation de ces signaux hypoxique et angiogénique (Görlach et al. 2008 ; Chandel et al. 2000).
Dans ce projet, le rôle du statut redox et inflammatoire, du signal hypoxique, de la néoangiogénèse et des propriétés physiques et mécaniques des thrombi seront évalués ainsi que leur dynamique de formation sur le risque d’endofuite de type 2 après chirurgie d’un anévrisme abdominale. Dans un 2e temps, l’effet d’un traitement pharmacologique anti-VEGF sur le risque d’endofuite de type 2 sera testé. PI : C Romanet-Faes et P Lermusiaux.
2.2. Approche mécanistique
Pour répondre à la question de l’effet per se de l’endoprothèse et son optimisation sur le risque de thrombose, la formation du caillot in vitro autour de prothèses vasculaires sera mesurée par échographie et élastographie afin d’identifier un traitement de surface approprié visant à limiter les propriétés hautement thrombogènes du dacron et du polyétrafluoroéthlyène (PTFE). PI : P Lermusiaux & C Romanet-Faes.

 Lyon - Saint-Etienne - Chambéry
Lyon - Saint-Etienne - Chambéry